Gas mulia adalah unsur-unsur golongan VIIIA (18) dalam tabel periodik. Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi). Tidak ditemukan satupun senyawa alami dari gas mulia. Menurut Lewis, kestabilan gas mulia tersebut disebabkan konfigurasi elektronnya yang terisi penuh, yaitu konfigurasi oktet (duplet untuk Helium). Kestabilan gas mulia dicerminkan oleh energi ionisasinya yang sangat besar, dan afinitas elektronnya yang sangat rendah (bertanda positif). Para ahli zaman dahulu yakin bahwa unsur-unsur gas mulia benar-benar inert. Pendapat ini dipatahkan, setelah pada tahun 1962, Neil Bartlett, seorang ahli kimia dari Kanada berhasil membuat senyawa xenon, yaitu XePtF6. Sejak itu, berbagai senyawa gas mulia berhasil dibuat. Gas mulia adalah gas yang mempunyai sifat lengai, tidak reaktif, dan susah bereaksi dengan bahan kimia lain. Gas mulia banyak digunakan dalam sektor perindustrian. Berikut adalah gas-gas mulia:
Sifat-Sifat Gas Mulia :
Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban).
Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF. Dalam waktu yang singkat ahli kimia yang lain menunjukkan bahwa Xenon dapat bereaksi langsung dengan Fluor membentuk XeF6,XeF4, dan XeF6. Sejak saat itu istilah inert tidak lagi sesuai dan para ahli kimia mulai menyebut dengan golongan gas mulia.
A. Sifat-sifat fisis
1) Wujud gas mulia
Unsur gas mulia terdapat sebagai gas tak berwarna yang monoatomik, ini erat kaitannya dengan struktur elektron oktet dan duplet dari gas mulia. Sedangkan wujud gas pada suhu kamar disebabkan titik cair dan titik didih gas mulia yang rendah.
2) Titik cair dan titik didih
Titik cair dan titik didih gas mulia meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar atom gas mulia sesuai bertambahnya massa atom relatif (Ar).
3) Kelarutan
Kelarutan gas mulia dalam air bertambah besar dari Helium (He) hingga Radon (Rn). Pada suhu 0 °C dalam 100 ml air terlarut 1 ml He, 6 ml Ar, dan 50 ml Rn.
B. Sifat-sifat kimia
Selama bertahun-tahun unsur gas mulia disebut sebagai gas inert. Sejak penemuan XePtF oleh Neil Bartlett anggapan gas inert gugur. Energi ionisasi kripton, Xenon dan Radon hampir sama dengan energi ionisasi oksigen dan masih lebih rendah dari fluor. Oleh karena itu dimungkinkan tiga unsur tersebut dapat membentuk senyawa dan telah dibuktikan oleh Bartlett. Radon dapat bereaksi spontan dengan fluor pada suhu kamar. Sementara Xenon memerlukan pemanasan atau permulaan reaksi secara fotokimia. Xenon dapat bereaksi dengan Fluor pada suhu 400 °C dan tekanan 6 atmosfer.
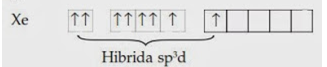
Kripton bereaksi dengan Fluor hanya bila keduanya dikenakan penyinaran atau pelepasan muatan listrik.Terbentuknya senyawa gas mulia dapat dijelaskan dengan hibridisasi. Perhatikan pembentukan ikatan XeF2Struktur elektron Xe dapat dituliskan :
Untuk membentuk XeF2 satu elektron 5p harus dipromosikan ke sub kulit 5d yang diikuti dengan pembentukan orbital hibrida sp3d.
Setelah mengalami hibridisasi dihasilkan.
Dua elektron yang tidak berpasangan tersebut digunakan untuk berikatan
dengan flour. Xe (dalam XeF2)












0 komentar:
Posting Komentar